생명체를 구성하는 4개의 Macromolecule(거대분자)인 탄수화물(Carbohydrate), 단백질(Protein), 지질(Lipid), 핵산(Nucleic acid)은 생명과학을 공부하다보면 다루지 않을 수가 없는 물질들이다. 그 중 단백질에 특히 주목하는 이유는 단백질은 효소를 구성하는 주요 구성요소이기 때문이다. 생명체 내의 물질대사는 효소에 의해 이뤄지고 또 통제되기 때문에 단백질을 모르고서 생화학을 공부하는 건 불가능에 가깝다.
그렇다면 단백질은 뭘로 구성되나요?
단백질의 기본 단위는 아미노산(Amino Acid; 축약어 AA)이다. 아미노산은 탄소를 중심으로 아래에 적혀있는 4개의 그룹이 부착된 형태이다. 이때 네 그룹을 연결하는 중심에 있는 탄소를 알파 탄소라고 부르기도 한다. (알파 탄소를 기준으로 추가적으로 탄소가 연결될 경우, 순서에 따라 베타 탄소, 감마 탄소...와 같이 그리스 문자 이름을 붙여서 명명하기도 한다)
- 아미노기 (NH2)
- 카복실기 (COOH)
- 수소 원자 (H)
- R기 라고도 부르는 Side chain (아미노산마다 다르기 때문에 아미노산을 구분하는 기준이 된다)

위 그림은 R기로 수소 원자 하나만을 가지는 가장 단순한 아미노산 글라이신을 나타낸 것이다. H2N에 연결된 ^의 꼭짓점 부분이 알파 탄소에 해당한다고 할 수 있겠다. 기본 수소 원자와 R기로서의 수소 원자는 모두 생략되어 있다.
그럼 아미노산은 어떤 공통적인 특징을 가지나요?
우선 아미노산은 알파 탄소에 결합한 그룹이 모두 다르기 때문에 (글라이신은 곁가지로 수소를 가지기 때문에 예외임) Chiral이다. 즉, 거울 이성질체가 존재하기 때문에 두 형태가 서로 구분된다. 그래서 L-이성질체와 D-이성질체가 존재할 수 있는데, 자연의 단백질에서는 압도적으로 L-이성질체만 발견된다. D-이성질체인 아미노산은 거의 없다고 봐도 무방하며, 간혹 발견될 경우 대부분은 이후 Modification 과정에서 변형되어서 발생한 것이다. 이는 D-이성질체가 L-이성질체보다 압도적인 탄수화물류와는 반대되는 단백질만의 특징이라고 할 수 있겠다.
잠시 딴 얘기로 빠져서, 만약 아미노산 관련 자료를 검색해보면 아미노기와 카복실기의 형태가 가끔씩 다르게 나타나는 것을 확인할 수 있다. 아미노기와 카복실기가 전하가 표시되지 않는 기본형태 (NH2, COOH)로 나타날 때도 있고, 전하가 있는 형태 (NH3+, COO-)로 나타날 때도 있다. 이는 해당 아미노산이 노출된 주변 환경의 영향 때문이다.
화학에서는 pKa라는 지표를 활용하는데, 간단히 설명하자면 해당 물질로부터 수소 이온이 얼마나 쉽게 떨어져나가는지 (즉, 수소를 얼마나 잘 제공하는지)를 판단할 수 있는 척도가 된다. 해당 물질이 노출된 pH가 pKa보다 낮다면 (예를 들어 pKa가 10인 물질이 pH가 7인 상황에 노출된다면) 해당 물질은 수소와 분리되지 못하고 결합된 상태로 존재한다. 이 상태를 'Protonated'라고도 한다. 점점 pH가 상승하여 pKa와 같아지면 수소를 잃은 상태와 그렇지 않은 상태의 비율이 1:1로 존재한다. 이보다 pH가 더 증가해서 pKa보다 커지면 해당 물질은 수소를 완전히 잃은 상태로 존재하게 된다. 이 상태를 'Deprotonated'라고도 한다.
헷갈리면 헨더슨-하셀바흐 방정식을 통해서 추론해보면 조금더 이해하기 쉬울 것 같다.
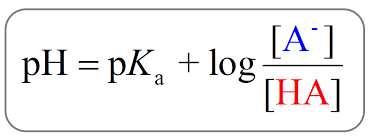
- pH - pKa < 0 (pH가 pKa보다 낮음): log[A-]/[HA] < 0 이므로 [HA]가 우세 (수소를 잃지 않은 형태가 우세함)
- pH - pKa = 0 (pH가 pKa와 같음): log[A-]/[HA] = 0 이므로 [A-]/[HA] = 1, 즉 두 상태의 비율이 1:1임
- pH - pKa > 0 (pH가 pKa보다 큼): log [A-]/[HA] > 0 이므로 [A-]가 우세 (수소를 잃은 형태가 우세함)
그러면 이걸 왜 설명했을까? 바로 Zwitterion form을 다루기 위해서이다. Zwitterion form은 한국어로 하면 양쪽성 이온이라고도 한다. 쉽게 말해서 한 분자 내에 양전하와 음전하가 모두 존재해서 분자 전체적으로 봤을 때는 중성이 되는 형태를 말한다.
카복실기(COOH)의 pKa는 일반적으로 2보다 작으며, 아미노기(NH2)의 pKa는 일반적으로 10보다 크다. 생명체 내의 환경은 일반적으로 pH가 7 안팎으로 유지된다. (이 조건을 Physiological condition이라고도 부르는데, 생화학은 기본적으로 생명체 내의 반응을 다루기 때문에 대부분의 화학반응은 이 조건에서 이뤄지는 것을 기본전제로 한다. pH 외에도 체온, 물이 풍부한 환경이 이에 해당한다) 이 pH에서는 위에서 언급했던 것처럼 카복실기는 수소를 잃은 상태가 우세하게 되며, 반대로 아미노기는 수소를 얻은 상태가 우세하게 된다. 그래서 일반적으로 카복실기는 COO-처럼 표시하며, 아미노기는 NH3+처럼 표시한다. 이를 반영한 아미노산의 구조는 아래와 같다!
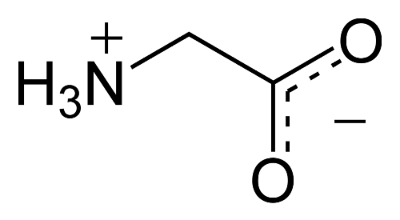
그럼 이제 여러가지 아미노산을 구분해봅시다
아미노산은 Side chain의 종류에 따라 종류가 구분되는데, 일반적으로 20개의 아미노산을 주요 아미노산으로 친다. (영어로는 Canonical amino acid라고 한다) 아미노산 자체는 위에 언급한 기본 구성만 지키면 Side chain에 어떤 물질이 오든 아미노산으로 판단할 수 있다. 하지만 그 중 단백질을 구성하는 아미노산이 대략 20개라서 이를 중요하게 다룬다. 나머지 아미노산은 일반적으로 단백질 합성 외에 신경물질 등 다른 용도로 활용되곤 한다. 물론 Selenocysteine, Pyrrolysine 등 예외적인 경우도 있지만 자세한 점은 그때 가서 알아보도록 하자.
20개의 아미노산은 Side chain의 특징에 따라서 아래와 같이 크게 4가지로 분류할 수 있다. 물론 이 분류는 교재에 따라 달라질 수 있으니 대략적인 틀로만 활용하고 시험을 대비할 때는 배운 교재에 맞춰서 하는 게 나을 것이다. 또 각자의 아미노산은 긴 이름 대신 3글자 축약어와 1글자 축약어가 존재한다. 4가지 분류 기준을 빠르게 훑고 넘어가보자.
- Hydrophobic: Side chain에 -OH 등 친수성 부분이 포함되어 있지 않다. 물에 노출되는 생명체 내의 환경 특성상 여기에 해당하는 아미노산들끼리 Hydrophobic interaction을 일으켜서 단백질 내부에서 발견되는 경우가 잦다.
- Polar: Hydrophobic에 비해 Hydrophilic한 성질을 띤다. -OH기 및 -SH기를 가지는 아미노산은 Nucelophile로 작용하기에 좋은 조건을 가지기 때문에 효소에서 중요한 역할을 하는 경우가 잦다.
- Positively charged: 생명체 내의 환경에서 거의 예외없이 양전하를 띠는 아미노산들이다. 염기성 아미노산으로도 불린다.
- Negatively charged: 생명체 내의 환경에서 거의 예외없이 음전하를 띠는 아미노산들이다. 산성 아미노산으로도 불린다.
간단하게 표로 정리하면 아래와 같다. 축약어는 일반적으로 풀네임의 앞글자를 따는 편이나, 간혹 예외가 있다. 이에 해당하는 것들은 볼드체로 표시해놓았다. 헷갈리기 쉬운 것에도 볼드체로 구분해놓았다.
| 해당하는 아미노산 | 각 아미노산의 3글자 축약어 | 각 아미노산의 1글자 축약어 | |
| Hydrophobic | Glycine (글라이신) Alanine (알라닌) Proline (프롤린) Valine (발린) Leucine (류신) Isoleucine (이소류신) Methionine (메싸이오닌) Tryptophan (트립토판) Phenylalanine (페닐알라닌) | Glycine → Gly Alanine → Ala Proline → Pro Valine → Val Leucine → Leu Isoleucine → Ile (ILE이다!) Methiionine → Met Tryptophan → Trp Phenylalanine → Phe | Glycine → G Alanine → A Proline → P Valine → V Leucine → L Isoleucine → I Methionine → M Tryptophan → W Phenylalanine → F |
| Polar | Serine (세린) Threonine (트레오닌) Tyrosine (타이로신) Cysteine (시스테인) Asparagine (아스파라긴) Glutamine (글루타민) | Serine → Ser Threonine → Thr Tyrosine → Tyr Cysteine → Cys Asparagine → Asn Glutamine → Gln | Serine → S Threonine → T Tyrosine → Y Cysteine → C Asparagine → N Glutamine → Q |
| Positively charged | Lysine (라이신) Arginine (아르기닌) Histidine (히스티딘) | Lysine → Lys Arginine → Arg Histidine → His | Lysine → K Arginine → R Histidine → H |
| Negatively charged | Aspartate (아스파르트산) Glutamate (글루탐산) | Aspartate → Asp Glutamate → Glu | Aspartate → D Glutamate → E |
그렇다면 20개의 아미노산들 중 특징적으로 지켜볼만한 아미노산은 어떤 것이 있을까? 이 내용은 다음 포스트에서 다뤄보도록 하겠다.
'생화학I' 카테고리의 다른 글
| [생화학I] 5. 단백질의 2차 구조 (1) 알파 나선 (0) | 2023.07.06 |
|---|---|
| [생화학I] 보충설명 (1): 폴리펩타이드에서 φ(Phi)와 ψ(Psi)를 측정하는 방법 (0) | 2023.07.04 |
| [생화학I] 4. 펩타이드 결합과 Ramachandran Plot (0) | 2023.07.03 |
| [생화학I] 3. 특이한 아미노산 3가지 (프롤린, 시스테인, 히스티딘) (0) | 2023.06.30 |
| [생화학I] 1. 생화학이 대체 뭐하는 과목인데 (2) | 2023.06.28 |



