앞선 글에서도 언급했지만 단백질은 1차 구조부터 4차 구조까지 여러 단계로 구성되어 있다. 3차 구조와 4차 구조는 결국 세부적인 2차 구조의 조합과 상호작용으로 구성되기 때문에 2차 구조를 아는게 아주 중요하다고 할 수 있겠다. 그러면 대표적인 2차 구조 중 하나인 알파 나선(Alpha-Helix)에 대해 알아보자.
알파 나선 구조가 뭔지 알아보자
알파 나선 구조는 이름 그대로 폴리 펩타이드 사슬이 마치 코일처럼 반복해서 회전하는 구조로 나타나는 것을 말한다. 아래 그림을 보면 대략 알파 나선 구조가 어떤 모습을 보이는지 알 수 있다. 만약 단백질의 구조를 나타낸 그림에서 나선이 발견되면 대부분 이 알파 나선이 있음을 나타낸다. 아래 그림은 이상적인 나선의 예시를 나타낸 것인데 n, p, right-handed 등 처음 보는 말이 나온다. 각각 의미하는 바가 무엇일까?
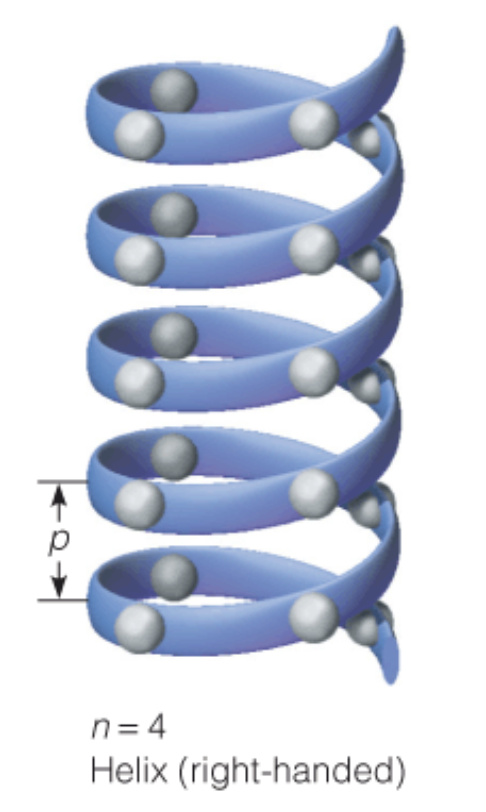
우선 n은 나선 상에서 한 바퀴를 돌기 위해서 필요한 폴리펩타이드 상 아미노산 Residue의 수로 정의된다. 위 그림을 보면 n=4로 나와있다. 그래서 각 나선의 한 바퀴가 4개의 아미노산으로 구성되어 있으며, k번째 아미노산과 같은 위치의 아미노산 (다음 나선 상에서)을 찾으려면 k+4번째 아미노산을 찾으면 된다. 참고로 n은 꼭 정수일 필요는 없다. 소수로 나오는 경우도 있다. 한 바퀴는 360도이니, 각 아미노산이 전 아미노산에 비해 회전하는 각을 구하려면 360도를 n으로 나눠주면 된다. (예시: n=3.6일 때, 각 아미노산은 이전 아미노산보다 100도씩 회전함)
h는 rise라고 부르는데, 한 아미노산과 다른 아미노산 사이의 높이 차로 정의된다. 용수철을 세워서 놓듯이 알파 나선 구조의 폴리펩타이드를 바닥에 세워놓는다고 생각해보자. 그러면 알파 나선 전체의 높이가 나올 것이고, 이를 해당 알파 나선을 이루는 아미노산들 사이 간격의 수로 나눠주면 각 아미노산 사이의 평균 높이를 구할 수 있다. 이를 h로 계산한다.
p는 pitch이다. pitch는 알파 나선의 한 지점과 다음 나선의 동일한 지점 사이의 높이 차로 정의된다. 앞서서 n과 h를 정의했기 때문에 간단하게 p를 n과 h의 곱으로 생각하면 편하다.
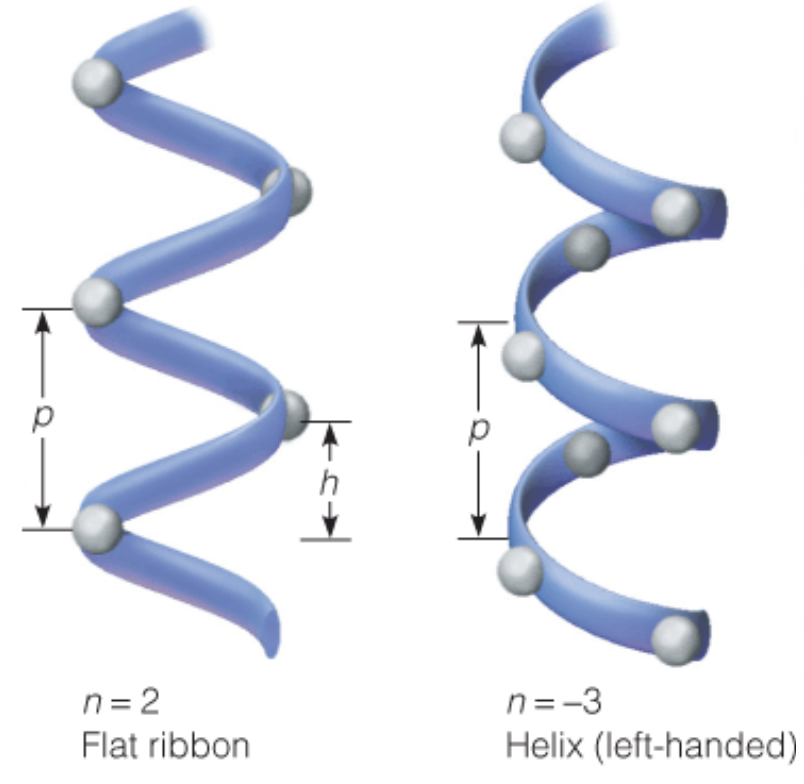
마지막은 Right-handed를 알아보자. 이는 나선의 방향을 나타낸다. Right-handed가 있으면 당연히 Left-handed도 존재한다. 그 기준은 생각보다 쉽게 판단할 수 있다. 나선의 시작 지점에 손바닥을 둔다고 생각하고, 나선을 손가락으로 감아보자. 이때, 오른손과 왼손 중 나선의 진행 방향과 손가락이 가리키는 방향이 일치하는 쪽으로 방향을 정하게 된다. 위 그림에서는 오른손으로 나선을 감아쥐었을 때 손가락이 나선을 따라가기 때문에 Right-handed이다. 참고로 나선의 방향에 따라 n이 다르게 나타나기도 한다. 우선 나선이 Left-handed이면 n이 음수로 나타난다. 또 오른손과 왼손 둘 중 한 방향으로 표시할 수 없는 경우는 n=2로 나타낸다. (이 경우는 Flat ribbon이라 한다)
알파 나선 구조의 특징
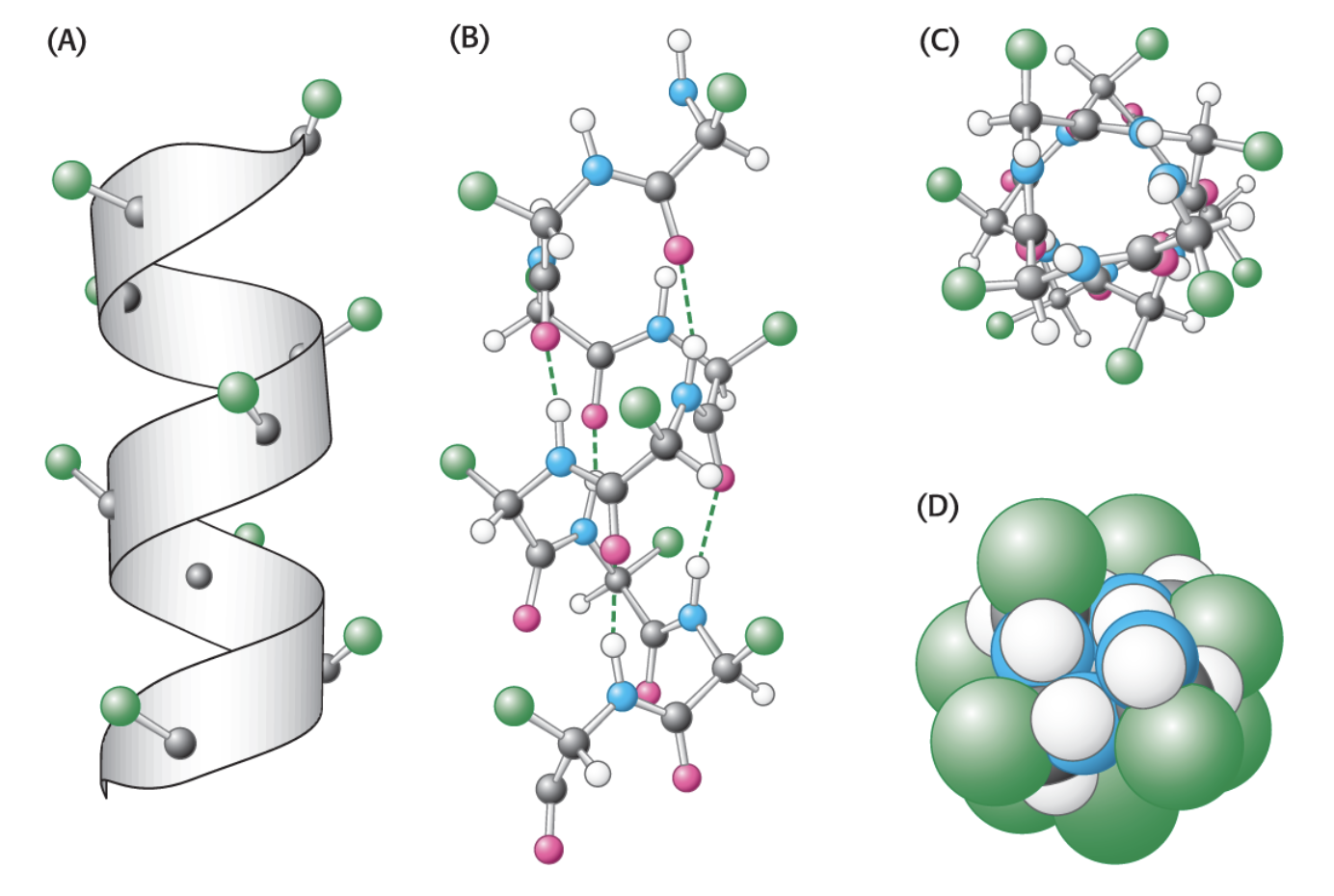
앞선 그림에서 표현된 알파 나선에서는 아미노산의 세부 구조가 나타나지 않는다. 그러면 실제로 알파 나선은 어떤 모습일까? 우선 가장 큰 특징은 Backbone이라 불리는 연속되는 펩타이드 결합들이 내부에 축으로 존재하며, 각 아미노산의 Side chain이 바깥으로 드러나는 구조로 되어 있다는 것이다. 위 그림의 (A)를 바라보면 이해가 쉬울 것 같다. (D)는 같은 구조를 위에서 바라보는 시선에서 그린 것인데, Side chain이 바깥으로 드러난 것을 확인할 수 있다.
이런 나선 구조가 유지될 수 있는 것은 수소 결합 때문이다. 수소 결합을 간략히 말하면 질소, 산소, 플루오린과 같이 전기음성도가 큰 원자에 결합한 수소가 다른 전기음성도가 큰 원자와 상호작용하여 강한 인력을 띠게 되는 것을 말한다. 알파 나선에서는 카보닐기와 아미노기 사이에서 수소 결합을 확인할 수 있다. 수소 결합은 k번째 아미노산이 가진 카보닐기의 산소와 k+4번째 아미노산이 가진 아미노기의 수소 사이에서 발생한다. 이런 수소 결합은 나선 양 끝에 있는 아미노산을 제외하면 모두 확인할 수 있다. 말로 풀어써서 헷갈린다면 아래 그림을 참고하자.
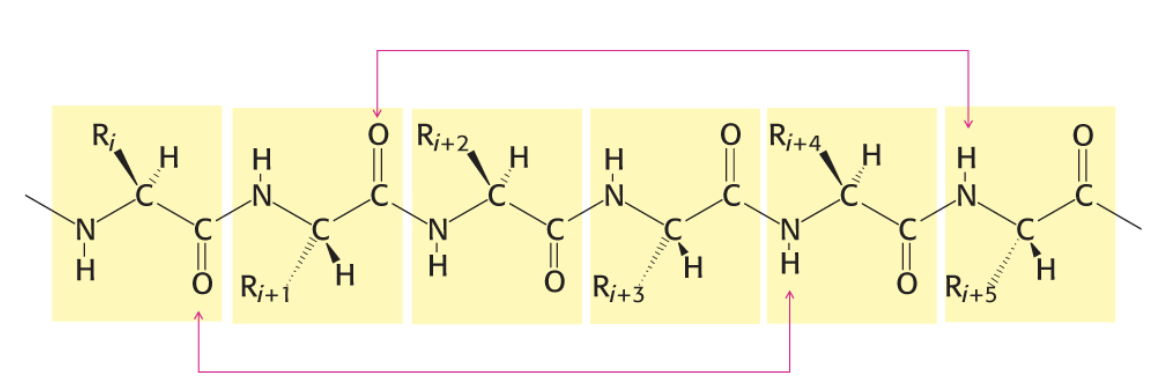
알파 나선 구조의 특징을 다루면서 처음 제시한 그림의 (B)에서 점선으로 나타난 것이 이 수소 결합이다. 붉은색이 카보닐기의 산소이며, 흰색이 아미노기의 수소이다. 이때, 수소는 파란색으로 표현된 질소에 연결되어 있는 것을 확인할 수 있다. 이러한 수소 결합이 알파 나선 내에 풍부하게 존재하기 때문에 구조가 안정되게 유지될 수 있다!
알파 나선이 성립하기 위한 조건은?
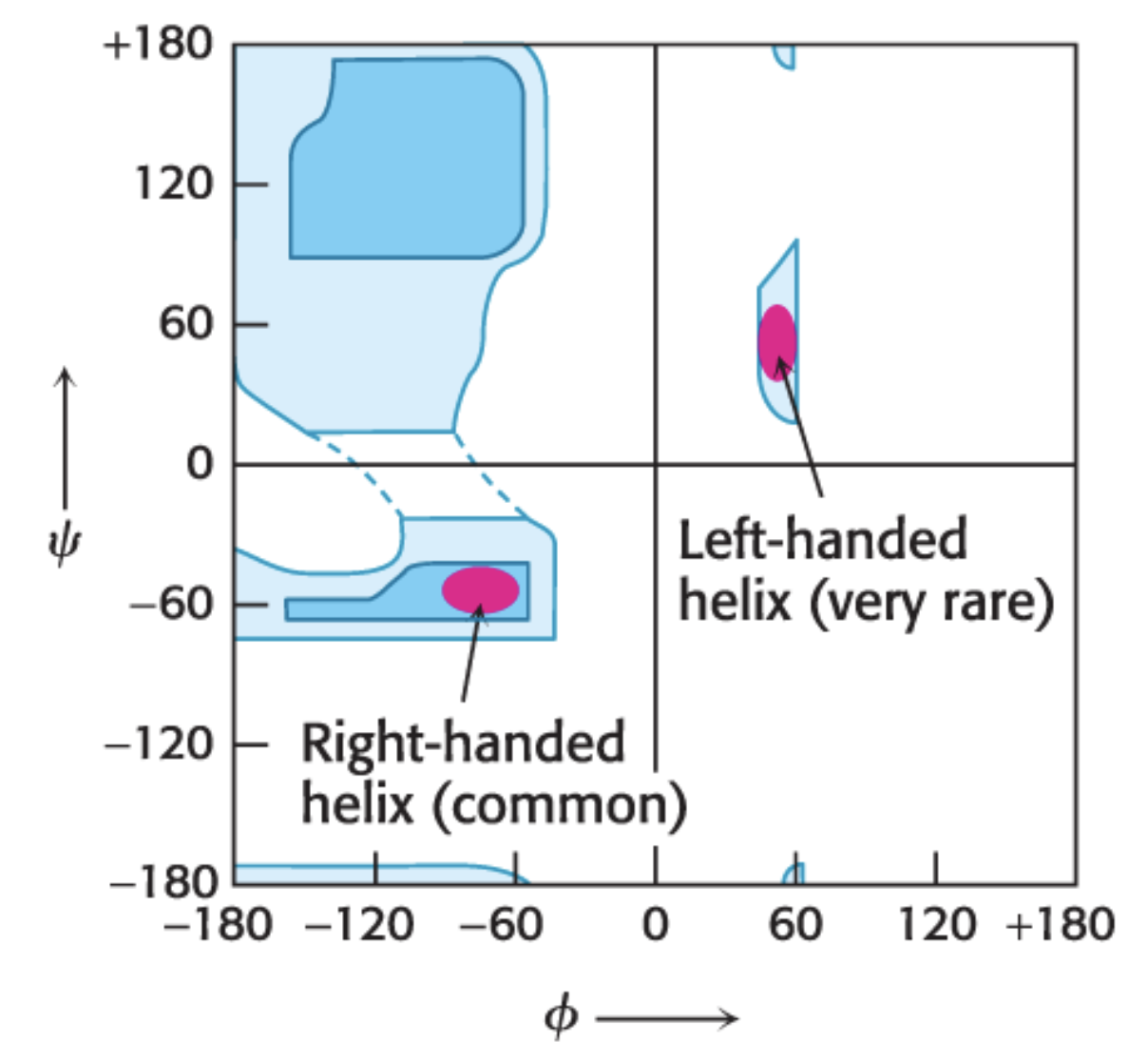
2차 구조가 성립하기 위한 조건은 Ramachandran Plot을 다룰 때 등장했었다. 다시 복습해보자. 위 그림에서 붉은 원으로 표시된 구역이 알파 나선이 성립하기 위한 회전각의 조건이다. 일반적으로 단백질에서 발견되는 알파 나선은 대부분 Right-handed이며, 이때 회전각은 약 φ=-57도, ψ=-47도이다.
그렇다고 위 각도 조건만 맞으면 무조건 알파 나선 구조가 형성되냐 하면 그건 또 아니다. 안정적으로 존재하기 위해서는 어떤 아미노산으로 구성되는지 또한 중요하다. 알파 나선 구조에 영향을 줄 수 있는 대표적인 아미노산은 아래와 같다.
- 1. 발린(Valine), 트레오닌(Threonine), 이소류신(Isoleucine)
- 2. 세린(Serine), 아스파르트산(Aspartate), 아스파라긴(Asparagine)
- 3. 프롤린(Proline)
세 그룹 모두 알파 나선을 약화시키는 (Destabilize) 아미노산들인데 이유가 다 다르다. 우선 첫번째 그룹에 속하는 발린, 트레오닌, 이소류신은 모두 공통적으로 베타 탄소에 추가적인 탄소 가지를 가지는 아미노산들이다. 아래의 그림에서 트레오닌을 한번 살펴보자.
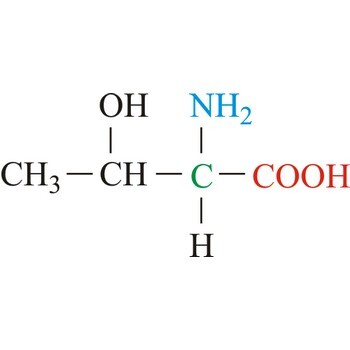
우선 베타 탄소가 뭔지 알아보자. 앞서 탄소는 알파, 베타, 감마와 같이 그리스 문자 이름을 활용하여 명명할 수 있다고 언급한 바 있다. 알파 탄소는 아미노산의 중심에서 아미노기, 카복실기, 수소, Side chain을 연결하는 중심 탄소이다. 위 그림에서는 초록색으로 표시된 탄소가 알파 탄소이다. 그렇다면 베타 탄소는 알파 탄소에 바로 결합된 탄소를 의미하게 된다. 아미노산에서 베타, 감마 탄소 등이 언급된다면 Side chain에서 알파 탄소부터 차례대로 이름을 붙이면 된다. 위 그림에서는 CH로 표시된 부분의 탄소가 베타 탄소가 되겠다. 만약 베타 탄소에서 Branch, 즉 일렬로 나열된 것이 아니라 위 그림처럼 가지 나뉘듯 두 개 이상의 그룹이 동시에 베타 탄소에 결합해 있는 경우가 첫번째 그룹의 특징이 되겠다.
앞선 설명을 잘 이해했다면 위에 있는 이소류신에서도 베타 탄소에서 뻗어져나오는 Branch를 발견할 수 있을 것이다. 이러한 Branch가 존재하게 되면 알파 나선이 차지하는 공간 범위를 침해해서 구조의 안정성이 감소한다. (이를 영어로는 Steric hindrance라고 하는데, 대응하는 번역어는 입체 효과라고 한다)
다음은 두번째 그룹이다. 두번째 그룹은 공통적으로 작은 크기의 극성인 Side chain (-OH를 포함하는 짧은 Side chain 등)을 가지는 아미노산이다. 앞서 알파 나선 구조가 아미노산의 Backbone을 이루는 아미노기와 카복실기 사이에 발생하는 수소 결합 때문이라고 언급했었다. 만약 두번째 그룹에 속하는 아미노산들이 알파 나선에 포함되면 Side chain에 있는 극성 부분들이 Backbone의 수소 결합에 영향을 주어 나선 구조를 약화시킬 수 있다. 즉, 나선을 유지하기 위해 필요한 수소 결합이 Backbone이 아닌 Side chain에 대신해서 만들어지는 것이다.
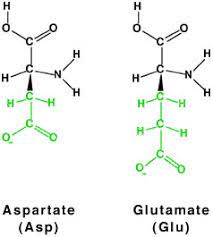
단순히 극성뿐만이 아닌 Side chain의 길이까지 고려하는 이유는 Side chain이 짧을 수록 극성 그룹이 Backbone에 영향을 주기 쉽기 때문이라고 판단된다. 위 그림을 보면 아스파르트산과 글루탐산은 구조가 거의 동일한데도 불구하고 Side chain의 길이 차이 때문에 (글루탐산이 더 길다) 아스파르트산의 경우만 알파 나선의 구조에 영향을 주는 것이다.
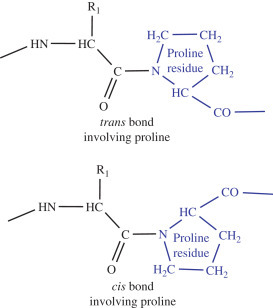
마지막으로 프롤린은 아주 간단하다. Side chain이 아미노기와 결합한 구조이기 때문에 카복실기의 산소와 상호작용할 수소 자체가 존재하지 않는다. 그래서 알파 나선 구조를 유지할 수 없다. 특이한 구조로 인한 공간 배치 상의 문제도 물론 포함된다. 그래서 프롤린을 Helix breaker라고도 표현한다.
이번 글에서는 알파 나선에 대해 자세하게 알아봤다. 어쩌다보니 글이 길어졌다. 또 다른 대표 2차 구조인 베타 병풍 구조에 대해서는 다음 글에서 알아보도록 하겠다.
'생화학I' 카테고리의 다른 글
| [생화학I] 7. 미오글로빈과 헤모글로빈, Heme 구조 (0) | 2023.07.09 |
|---|---|
| [생화학I] 6. 단백질의 2차 구조 (2) 베타 병풍, Turn, Loop (0) | 2023.07.07 |
| [생화학I] 보충설명 (1): 폴리펩타이드에서 φ(Phi)와 ψ(Psi)를 측정하는 방법 (0) | 2023.07.04 |
| [생화학I] 4. 펩타이드 결합과 Ramachandran Plot (0) | 2023.07.03 |
| [생화학I] 3. 특이한 아미노산 3가지 (프롤린, 시스테인, 히스티딘) (0) | 2023.06.30 |



