단백질이 보편적으로 가지는 특징을 앞선 글에서 다루어보았다. 그렇다면 앞으로 몇개의 글을 통해 대표적인 단백질 미오글로빈과 헤모글로빈을 통해서 단백질이 실제로 체내에서 어떻게 활용되고, 활성 정도를 어떻게 해석하고, 경우에 따라 어떻게 조절되는지를 알아보도록 하겠다.
미오글로빈과 헤모글로빈의 역할과 구조
미오글로빈(Myoglobin)과 헤모글로빈(Hemoglobin)의 가장 중요한 역할은 산소 운반이다. 사람을 비롯한 대부분의 생물은 산소 호흡을 도입하였기 때문에 신체를 이루는 모든 세포에 산소가 원활히 공급되어야 한다. 만약 생명체의 크기가 아주 작아서 외부와 바로 산소 교환을 원활히 할 수 있다면 상관 없겠지만, 우리 주변의 대부분의 생명체는 그렇지 않다. 그렇기 때문에 산소 운반을 도와주는 메커니즘이 다양하게 존재하는데, 척추동물에서는 이 메커니즘이 미오글로빈과 헤모글로빈을 통해 이루어진다.
두 단백질 모두 산소가 풍부한 환경으로부터 산소를 얻어서 산소가 부족한 곳에서 산소를 방출하는 메커니즘으로 산소를 공급한다. 다만 자세한 면에서는 차이가 존재한다. 우선 헤모글로빈은 산소를 폐에서 체내의 조직으로 이동하는 역할을 담당한다. 적혈구에서 발견될 수 있으며, 총 4개의 단위체로 구성된 사량체(Tetramer)이다. 반대로 미오글로빈은 근육에서 흔히 발견되며, 헤모글로빈에 의해 세포 내에 전달된 산소가 미토콘드리아로 전달되는 것을 돕기도 한다. 또 하나의 단위체로 구성된 단량체(Monomer)이다.
이때 헤모글로빈을 구성하는 4개의 단위체는 모두 같지 않으며, 서로 다른 2개의 단위체가 각각 2개씩 모여서 구성된다. 단위체는 각각 Alpha와 Beta로 나뉘며, 각각의 단위체는 또 세부적으로 여러 알파 나선 구조의 집합으로 구성된다. Alpha 단위체와 Beta 단위체를 구분하는 방법은 D Helix의 존재 유무이다. Alpha 단위체는 D Helix가 없어서 C Helix 다음에 바로 E Helix가 오며, Beta는 그렇지 않다. 이해하기 어려우면 아래 그림에서 직접 찾아보도록 하자.

Heme의 기능과 구조
미오글로빈과 헤모글로빈을 구성하는 여러 요소 중 산소 운반에서 가장 핵심적인 것은 Heme이다. Heme은 프로토포르피린 IX(Protoporphyrin IX)과 철(Fe2+)이 결합하여 구성된다. 이때 철은 반드시 Fe2+여야만 한다. 만약 세포 내 환경이 아니라 공기 중에 미오글로빈 또는 헤모글로빈이 노출되면 산소와 결합하지 않는데, 그 이유는 철이 Fe2+에서 Fe3+로 산화되기 때문이다. 만약 철이 Fe3+로 산화되면 더이상 산소와 결합할 수 없고, 대신해서 물이 결합하게 된다. 이를 미오글로빈을 예로하여 정리하면 아래와 같다.

- Heme의 철이 Fe2+이지만 산소가 결합하지 않음: Deoxymyoglobin, 보라색, 정맥혈의 색(Venous purple)
- Heme의 철이 Fe2+이며 산소가 결합함: Oxymyoglobin, 밝은 적색, 동맥혈의 색(Bright red)
- Heme의 철이 Fe3+으로 산화됨: Metmyoglobin(Methemoglobin으로 표현하기도 함), 연갈색
프로토포르피린 IX은 Tetrapyrrole 구조인데, 이는 4개의 Pyrrole이 모여서 고리 형태를 이루는 것을 의미한다. Fe2+는 이렇게 형성된 고리의 가운데에 위치한다. 그렇기 때문에 Heme을 다른말로 Ferroprotoporphyrin으로 부르기도 한다. 아래와 같이 구성된 Heme은 서로 같은 하나의 평면에 위치한다.

그러면 이러한 Heme은 어떻게 단백질에 결합하게 될까? 철 이온은 리간드 결합 구역(Ligand binding site)가 팔면체 형태(Octahedral coordination)로 되어 있다. 리간드(Ligand)는 금속 이온을 중심으로 결합하는 원자나 분자들을 의미하는데, 쉽게 말해 철 이온을 중심으로 분자나 원자들이 팔면체 형태로 결합할 수 있다는 것이다. 왜 팔면체냐고 하면은 모든 리간드 사이를 선으로 연결해서 구조를 그리면 그게 아래의 그림처럼 팔면체로 나타나기 때문이다. 이 사실을 통해 철 이온은 6개의 리간드 결합 구역을 가진다는 점을 알 수 있다.

철이 가진 6개의 리간드 결합 구역 중 4개는 Heme을 이루는 프로토포르피린 IX 고리에 의해 이미 차지되었다. 그러면 남은 두 리간드 결합 구역을 통해 Heme이 단백질 구역과 연결된다는 점을 알 수 있다. 여기서 히스티딘이 활용되는데, 2가지 방법으로 활용된다. 우선 첫번째 히스티딘은 철에 직접적으로 결합해서 Heme을 단백질과 연결한다. 그리고 두번째 히스티딘은 철 이온과 산소의 결합을 유지시킨다.
이를 요약하면, 철 이온을 중심으로 봤을 때 같은 평면 상에 있는 4개의 리간드 결합 구역은 프로토포르피린 IX와 결합해 있으며, 나머지 두 구역 중 하나는 히스티딘과 직접적으로 연결되어 있다. 마지막 한 구역에는 산소가 위치해 있으며, 이 상태는 반대편 히스티딘에 의해 유지된다.
여기서 두 히스티딘을 각각 구분하는데, 철과 직접적으로 결합하는 히스티딘을 His 93 또는 His F8이라고 한다. Proximal 히스티딘이라고도 한다. 반대로 철과 산소의 결합을 유지해주는 히스티딘을 His 64 또는 His E7라고 한다. Distal 히스티딘이라고도 한다. 여기서 F나 E를 붙여서 표현하는 방식과 숫자로만 표시하는 방식은 폴리펩타이드를 바라보는 시선에 따라 달라진 것인데, 결국 동일한 아미노산을 가리키고 있는 것이다. 단순하게 숫자로만 표현한 것은 폴리펩타이드 사슬을 쭉 늘어뜰여서 1번부터 마지막까지 번호를 메겼을 때, 이 히스티딘이 몇 번째 아미노산인지를 가리킨다. 알파벳을 활용하는 방식은 해당 히스티딘이 어떤 Helix의 몇번째 아미노산인지를 밝히는 방식이다.

헷갈린다면 아래 그림 자료에서 Proximal His와 Distal His를 찾아보자. Mb는 미오글로빈, Hb-alpha는 헤모글로빈의 Alpha 단위체, Hb-beta는 헤모글로빈의 Beta 단위체를 이루는 폴리펩타이드 서열이다. 이때 알파벳으로 표시된 것은 1자리 줄임말로 표현된 아미노산이며, -는 다른 폴리펩타이드에는 존재하는 아미노산에 대응하는 아미노산이 존재하지 않음을 의미한다. 즉 대조를 위해 나열하는 과정에서 발생한 공란이며, 실제로도 불연속적으로 폴리펩타이드가 이어지는 것은 아니다. (Alpha에서는 위의 글에서도 언급했지만 Beta에서 D에 대응하는 부분의 아미노산이 공란으로 나타나있다)

Heme의 작동방식
Heme의 철과 산소가 상호작용할 경우, 공명 구조가 존재할 수 있다. 일반적으로는 O2산소 분자와 정상적인 Fe2+으로 존재하지만, 전자가 이동하여 O2- Superoxide ion(초과산화물)과 Fe3+으로도 존재할 수 있다.
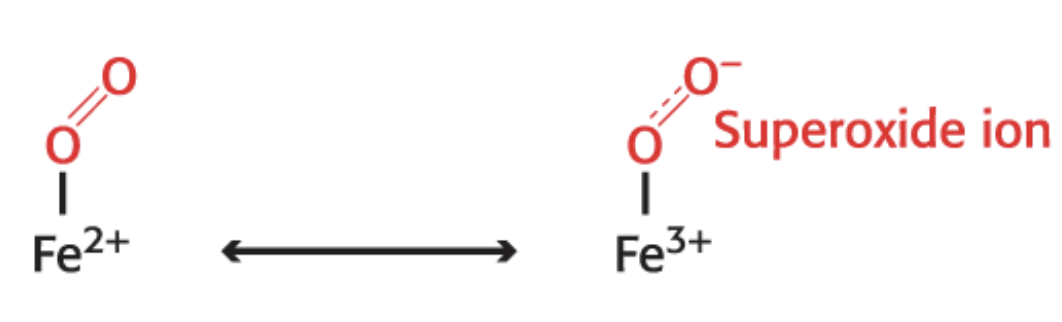
후자의 상태로 존재하는 것은 아주 위험한 일이다. 예를 들어서 만약에 Fe3+와 Superoxide ion이 분리되었다고 생각해보자. 우선 Heme의 철이 Fe3+ 상태가 되면 앞서 말했듯 미오글로빈은 더 이상 산소와 결합할 수 없는 Metmyoglobin으로 변화한다. 또 세포 내로 방출된 Superoxide ion은 아주 강한 반응성을 가지기 때문에 세포 내의 다른 필수적인 분자들과 빠르게 반응하여 세포를 손상시킬 수 있다. 만약 후자의 상태를 억제하는 메커니즘이 존재하지 않는다면 시간이 흐를수록 산소가 결합할 수 없는 Fe3+ 상태의 Metmyoglobin은 점점 누적될 것이고, Superoxide는 계속해서 방출되어 세포를 파괴할 것이다. 이를 Autooxidation이라고 한다.
이를 가능케 하는 가장 큰 기반은 Distal 히스티딘이다. Distal 히스티딘은 후자의 상태에서 철과 산소의 결합이 끊어지지 못하게 한다. 즉, 산소가 언제나 Fe2+ 상태일 때만 방출될 수 있도록 한다. 이를 가능케 하는 것은 히스티딘의 이미다졸 고리에 존재하는 질소에 결합된 수소가 산소와 수소 결합을 이루기 때문이다. 이때 발생하는 수소 결합은 물 분자의 해리(Dissociation)와 산화 반응을 억제한다고 알려져있다. 따라서 Distal 히스티딘을 수소 결합이 불가능한 아미노산으로 대체하면 Autooxidation이 증가하는 것을 볼 수 있다.
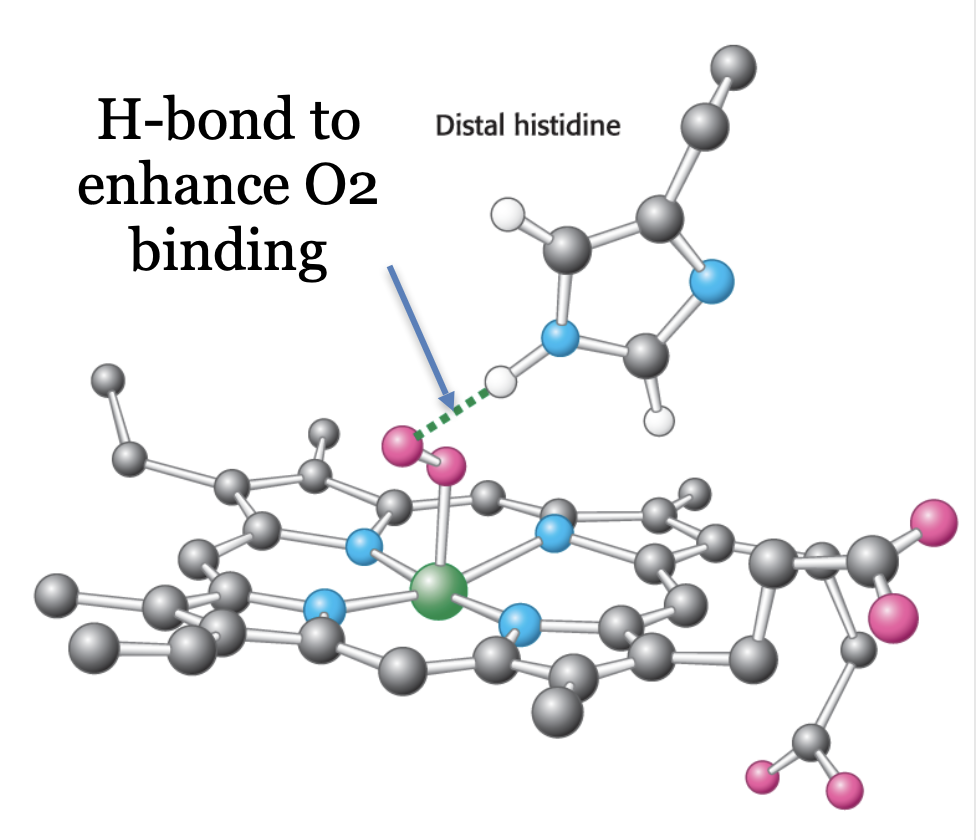
추가적으로, Heme이 위치하는 미오글로빈이나 헤모글로빈의 Hydrophobic한 3차 구조를 Heme pocket이라 부르는데, 그 중 Distal 히스티딘이 존재하는 면을 따로 Distal pocket이라고 한다. 이때 Distal pocket에 존재하는 크기가 작은 아미노산(E11; Val 68의 발린 또는 B10; Leu 29의 류신)을 부피가 큰 아미노산들(페닐알라닌, 타이로신, 트립토판 등 방향족 Side chain을 가진 아미노산 등)으로 대체하여 Distal pocket의 부피를 줄일 경우에도 Autooxidation이 감소한다. 이는 Pocket의 크기가 감소함에 따라 철 원자가 물 분자와 상호작용할 가능성을 감소시키기 때문이다.
반면에 Distal pocket을 다르게 조작하면 Autooxidation을 증가시킬 수도 있다. Distal pocket의 Val 68(Hydrophobic 아미노산으로 분류된다)을 세린(Ser) 또는 트레오닌(Thr) 등 극성 아미노산으로 바꿔서 극성(Polarity)을 증가시키면 O2-Fe2+ 복합체가 양성자첨가(Protonation) 반응에 참여하는 것을 촉진하게 된다. 따라서 Autooxidation이 전보다 증가한다. 이 외에도 Heme 부근의 단백질 표면에 음전하를 증가시키면 비슷하게 Autooxidation이 증가한다.
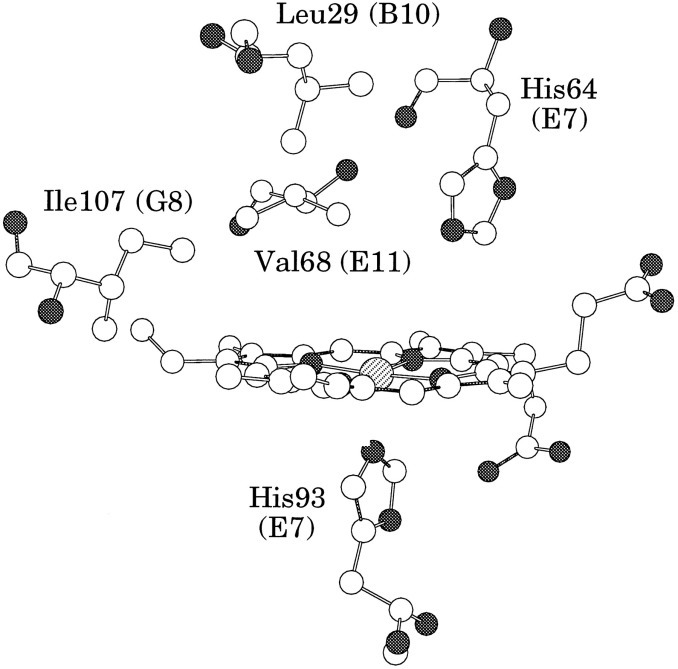
다시 히스티딘으로 돌아가보자. 히스티딘의 수소 결합은 산소 분자 자체의 결합 친화도(Affinity)를 상대적으로 증가시키는 역할도 한다. 일산화탄소는 산소에 비해 200배 더 강력하게 결합하는 것으로 알려져있으나, 만약 수소 결합이 없다면 일산화탄소 친화도가 산소의 6000배에 달할 것이라는 연구가 있다. 즉 일산화탄소 등 다른 분자와는 수소 결합을 형성하지 않고, 산소와만 수소 결합을 형성함으로써 조금이라도 산소가 더 결합할 수 있도록 도와주는 역할을 한다.
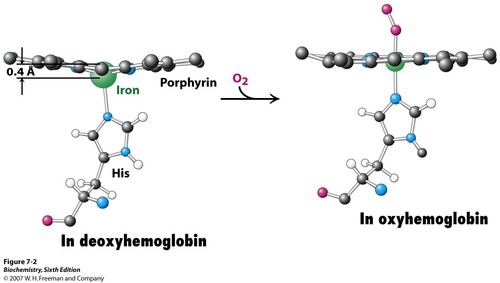
앞서 heme을 설명할 때 철 이온과 포르피린 고리가 같은 평면 상에 존재한다고 언급했었는데, 사실 완전한 평면은 아니다. 그 이유는 철 이온이 포르피린 고리에 가운데에 존재하는 빈 공간보다 크기가 좀 더 크기 때문이다. 그래서 철 이온이 가운데 공간에 완벽하게 위치할 수 없고 평면 상에서 약간 벗어난 위치에 존재하게 된다. 이 상태가 위 그림의 왼쪽에 나타나 것이다. 그런데 산소가 결합하게 되면 상황이 달라진다. 철이 산소와 결합하면서 전자의 상태가 변화하고, 전보다 크기가 약간 작아지게 된다. 이 상태일 때 철 이온은 포르피린 고리 정가운데에 위치할 수 있고, heme은 같은 평면 상에 놓이게 된다. 이 상태가 위 그림 오른쪽에서 확인할 수 있다. 이 원리를 활용하면 헤모글로빈에 산소가 얼마나 많이 결합했는지를 측정하고, 혈류 내 헤모글로빈의 포화 정도가 얼마인지 파악할 수 있다. 이를 응용한 기술이 fMRI이다.
여기까지 미오글로빈과 헤모글로빈이 무엇이며, 이들이 산소 운반을 할 수 있게 돕는 Heme에 대해 자세히 알아봤다. 다음 글에서는 지금까지 다뤘던 내용을 바탕으로 미오글로빈과 헤모글로빈이 실제 체내에서 산소 분압에 따라 어떻게 작용하는지 알아보고, Hill equation을 유도해보도록 하겠다.
'생화학I' 카테고리의 다른 글
| [생화학I] 9. 헤모글로빈의 Hill equation과 Allosteric Effect (0) | 2023.07.15 |
|---|---|
| [생화학I] 8. Hill equation으로 미오글로빈 해석하기 (0) | 2023.07.10 |
| [생화학I] 6. 단백질의 2차 구조 (2) 베타 병풍, Turn, Loop (0) | 2023.07.07 |
| [생화학I] 5. 단백질의 2차 구조 (1) 알파 나선 (0) | 2023.07.06 |
| [생화학I] 보충설명 (1): 폴리펩타이드에서 φ(Phi)와 ψ(Psi)를 측정하는 방법 (0) | 2023.07.04 |



