20개의 주요 아미노산 모두 중요하지만 그중에서도 몇 아미노산은 특이해서 짚고 넘어가야할 점들이 있다. 순서대로 프롤린, 시스테인, 히스티딘을 알아보려고 한다.
1. 프롤린 (Proline)
프롤린은 20개의 아미노산 중에서 유일하게 Side chain이 아미노기와 공유 결합을 형성하는 아미노산이다. 아래에 나와있는 프롤린의 구조를 보면 NH에 연결된 알파탄소로부터 고리가 형성되는 것을 관찰할 수 있다. (알파탄소에 고리가 있는 Side chain이 결합한 게 아닌, 알파탄소 자신이 고리구조에 포함되어 있는거다!) 이 때문에 3차원 구조가 다른 아미노산과는 독특한 양상을 보이게 되는데, 이후 펩타이드 결합을 형성할 때 영향을 미치게 된다. 나중에 다룰 Ramachandran Plot에서도 같은 이유 때문에 프롤린이 아마 한번 더 언급될 예정이다.
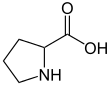
2. 시스테인 (Cysteine)
시스테인은 -SH기를 가진 유일한 아미노산이다. 시스테인의 Side chain은 pKa가 약 8.3으로, pH가 조금 높은 조건에서 이온화될 수 있다. 이때 수소를 잃은 S-는 2개가 모였을 때 Disulfide bond를 형성한다. 그리고 이때 Disulfide bond를 가지게 된 생성물을 Cystine이라고 한다. 중요한 점은 이 결합이 공유결합이라는 거다. 단백질의 3차원 구조는 단백질을 이루는 아미노산 사이에 존재하는 비공유 결합 상호작용(수소결합, 반데르발스 힘, 소수성 상호작용 등)에 크게 의존한다. 공유결합은 이들보다 훨씬 강한 결합이기 때문에 Disulfide bond가 단백질 내에서 구조를 유지하는 데 큰 기여를 한다고 볼 수 있다. 예시로는 Immunoglobulin G에서 Heavy chain, Light chain이 모두 Disulfide bond로 단단하게 연결되어서 구조를 유지하는 것을 들 수가 있겠다.
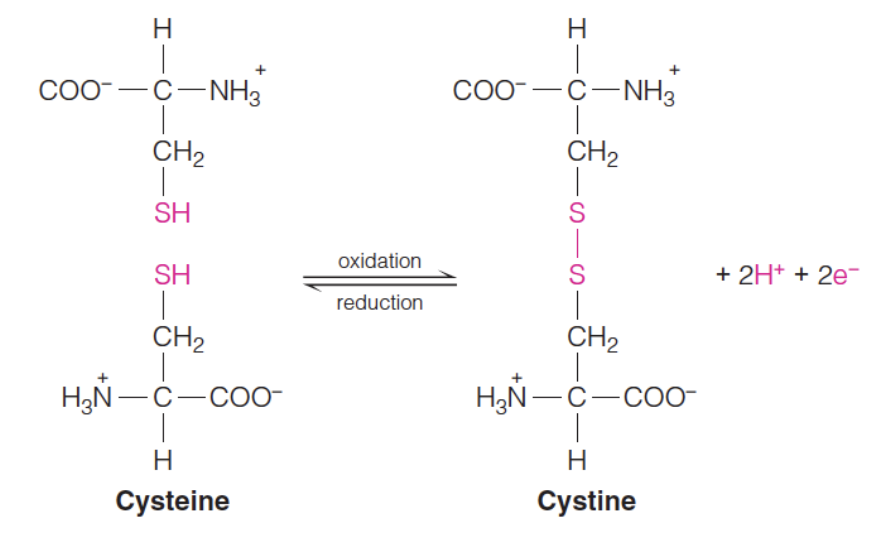
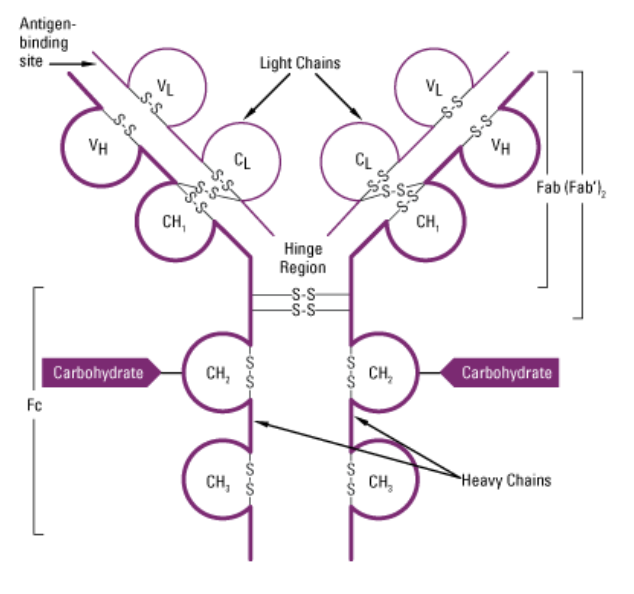
3. 히스티딘 (Histidine)
사실 프롤린이랑 시스테인은 고등학교 과정에서도 한번 다루고 넘어갈 만큼 아주 기본적인 거라서 뭐 더 특별한 것은 없다. 중요한 건 히스티딘이다! 히스티딘은 양성자 전달을 포함하는 효소 촉매작용에서 중요한 역할을 하는 경우가 많다. 그러면 히스티딘의 어떤 특징 때문에 이것이 가능한지 알아보도록 하자.
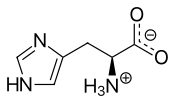
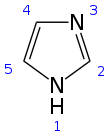
히스티딘을 보면 알파 탄소에 이미다졸 고리가 포함된 Side chain이 결합된 구조임을 확인할 수 있다. 이 구조로 인해 히스티딘은 단백질 내에서 pKa가 6.5-7.4 정도의 범위를 가진다. 당연히 체내의 pH는 7 전후이기 때문에 pKa가 미세하게 바뀔 때마다 히스티딘이 양성자를 얻는지 잃는지가 결정된다. 히스티딘과 함께 Positive charged 아미노산으로 분류되는 라이신과 아르기닌의 Side chain pKa가 각각 10.54, 12.48로 아주 높다는 것을 감안하면 차이가 크다. 라이신과 아르기닌은 pKa가 높기 때문에 체내에서는 거의 언제나 양성자를 얻은 형태로만 존재하는 한편 히스티딘은 주변 환경에 따라 조절이 가능하게 된다. (이를 히스티딘이 라이신, 아르기닌, 히스티딘 중 Least Basic한 성질을 갖는다고도 표현한다) 이때 양성자가 결합되는 곳은 위의 그림에서 3번으로 표현된 질소 부분이다.
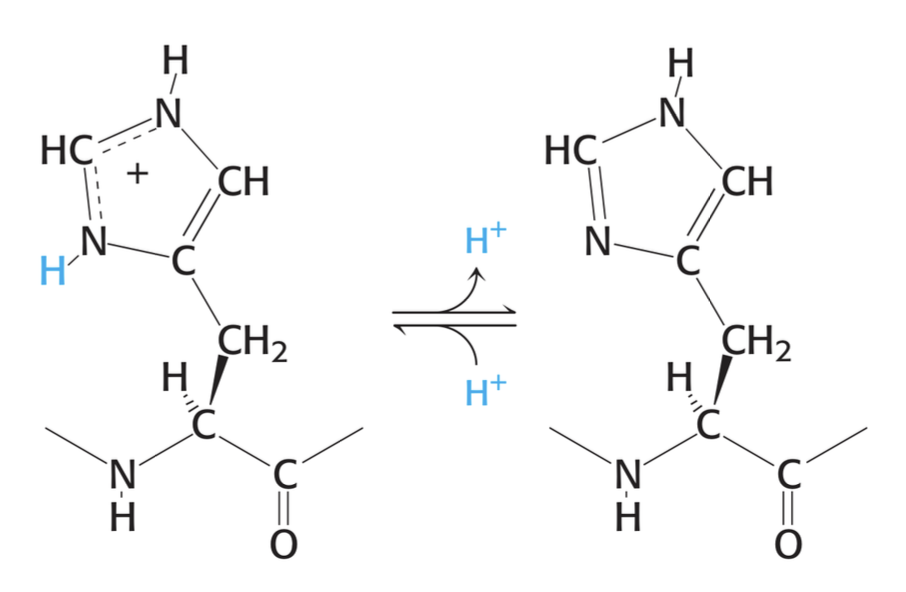
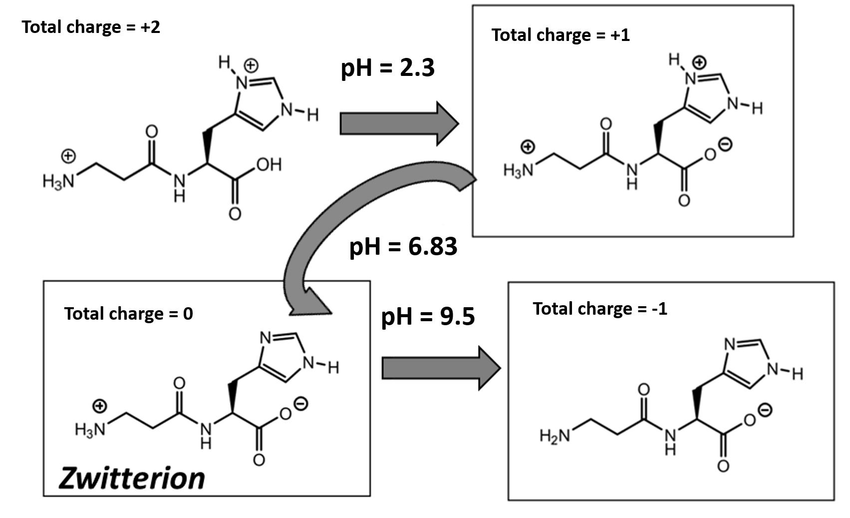
그래서 간혹 시험에서 히스티딘 기본 구조를 딱 던져주고 pH에 따라서 올바른 형태를 그리라는 문제가 나오기도 한다. 왜냐하면 내가 풀어봤기 때문이다. pH에 따라서 카복실기, 아미노기, 이미다졸의 상태를 올바르게 그리는 건데, 아래에 나와있는 pH별 상황을 그냥 무식하게 외워도 상관없지만 그것은 별로 추천하지 않는다.
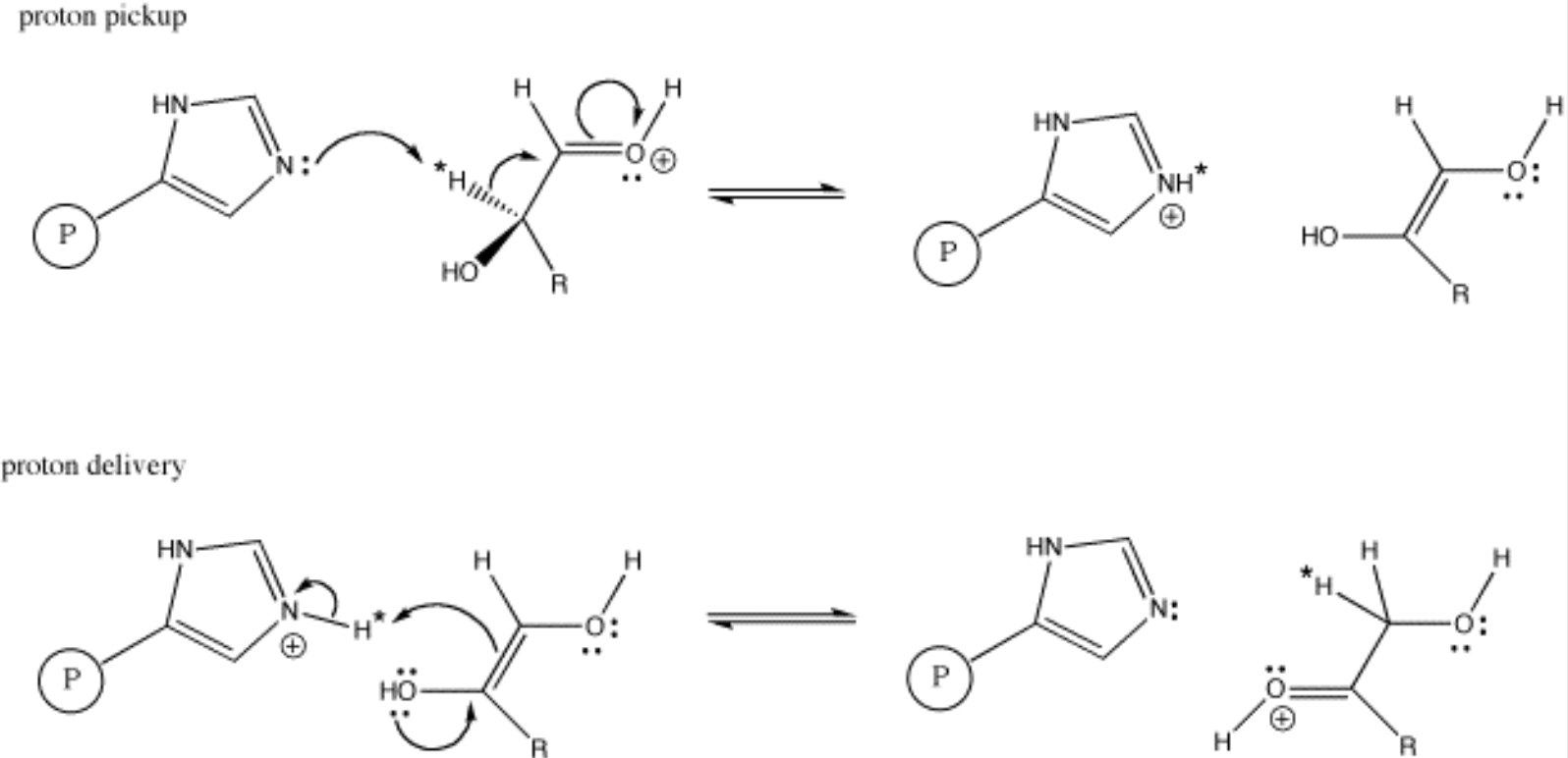
생체 환경 조건에서 양성자를 얻고 잃기 쉽다는 이런 히스티딘의 특징 덕분에 히스티딘은 단백질 내에서 양성자 전달자로 주로 많이 활용될 수 있다. 아래 그림은 실제로 활용되는 예시를 나타낸 것인데, P가 이미다졸 고리가 포함된 히스티딘 및 히스티딘이 결합된 단백질을 의미한다.
이 3개의 아미노산 외에도 글라이신을 특이한 아미노산으로 뽑기도 한다. 그 이유는 별게 아니라 Side chain 자체가 너무 작기 때문이다. 물리적인 크기 자체가 작아서 이후 Ramachandran Plot을 포함해서 펩타이드 결합을 형성할 때 다른 아미노산과는 구분되는 양상을 보이기도 한다.
그러면 아미노산은 충분히 다뤄봤으니 다음 글에서는 단백질의 가장 기본이 되는 Primary structure가 뭔지, 그리고 이를 구성하는 펩타이드 결합이 어떻게 이뤄지는지 알아보도록 하자.
'생화학I' 카테고리의 다른 글
| [생화학I] 5. 단백질의 2차 구조 (1) 알파 나선 (0) | 2023.07.06 |
|---|---|
| [생화학I] 보충설명 (1): 폴리펩타이드에서 φ(Phi)와 ψ(Psi)를 측정하는 방법 (0) | 2023.07.04 |
| [생화학I] 4. 펩타이드 결합과 Ramachandran Plot (0) | 2023.07.03 |
| [생화학I] 2. 아미노산의 구성과 특징 (0) | 2023.06.29 |
| [생화학I] 1. 생화학이 대체 뭐하는 과목인데 (2) | 2023.06.28 |



